Laboratorios han puesto en el mercado envases adaptados al nuevo sistema cuyos códigos no se habrían cargado en EMVO por lo que pueden darse casos, en el momento de la dispensación, que no permitan la desactivación del código.
Verificación: habrá envases serializados que no se podrán desactivar el día 9 de febrero
A menos de dos semanas de que entre en vigor en la Unión Europea el sistema de verificación de medicamentos, como parte del cumplimiento de la Directiva 2011/62/UE para prevenir la entrada de fármacos falsificados, todo parece indicar que España no podrá cumplir stricto sensu.
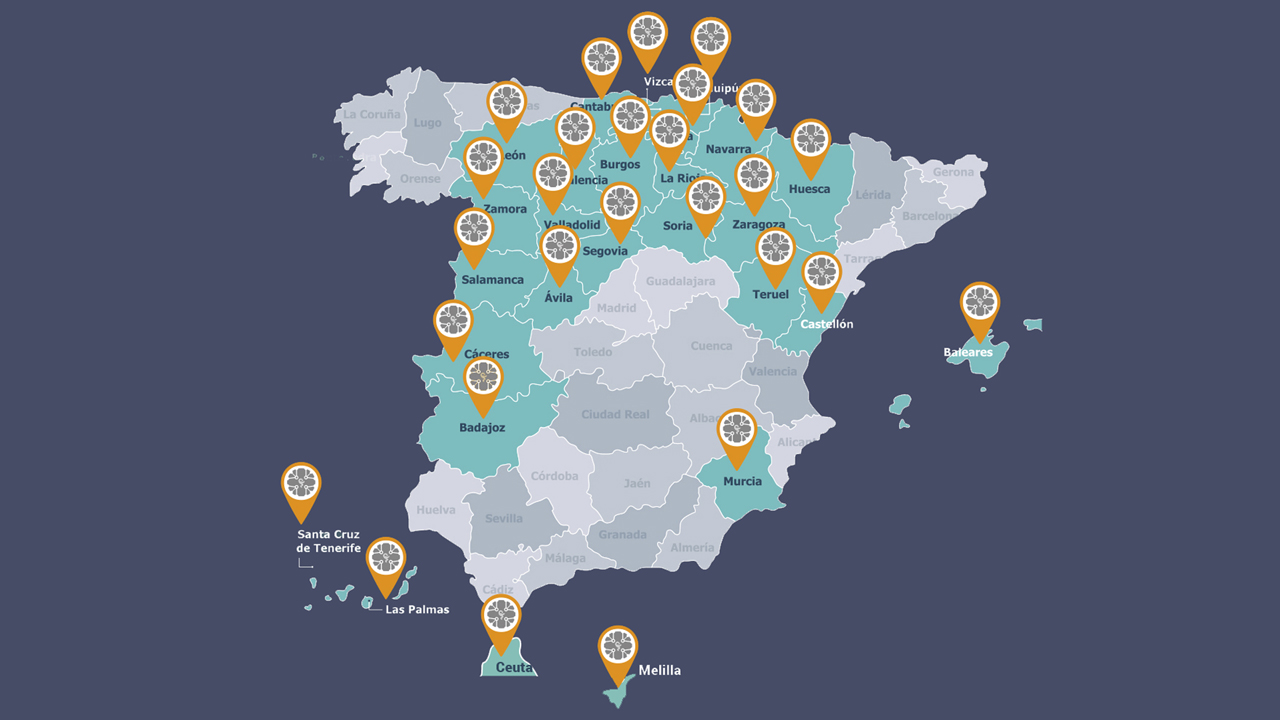
Colegios de farmacéuticos conectados a Sevem a fecha de 23 de enero de 2019.
Un proyecto de la complejidad de éste, considerado uno de los hitos más importantes en el sector farmacéutico en las últimas décadas y desde luego el más importante en materia de digitalización, tenía que tener trabas e inconvenientes, pero lo cierto es que el día a día se perfila más complicado de lo que los integrantes del Sistema Español de Verificación de Medicamentos (Sevem) esperaban, teniendo en cuenta los “esfuerzos realizados” en los últimos tiempos y el “esprint final” que están realizando las farmacias para llegar a la fecha prevista (ver mapa), reconocen.
Uno de los principales problemas con los que no se contaba es que desde la plataforma europea EMVO (el equivalente a Sevem y centralizador de los datos de la UE) han reconocido que ya se han comercializado envases con identificador único –incorporado en un código bidimensional Data Matrix y también en formato legible– cuyos códigos no están cargados en los repositorios nacionales ni europeo, por lo que habrá farmacias que a partir del sábado 9 de febrero no puedan autenticarlos.
Será una alerta, pero se permitirá la dispensación
¿Esto en qué se traduce? Pues que el sistema generará una alerta en el terminal de la botica que le impedirá desactivar el código y, por lo tanto, debería inmovilizar el producto. Sin embargo, el aviso del EMVO precisamente se ha producido para que los agentes se pusieran manos a la obra en la búsqueda de soluciones y den prioridad a cubrir las necesidades del paciente.
Explican a CF fuentes del Sevem que en España se darán instrucciones a las farmacias para que, cuando esto se produzca, se permita, “bajo responsabilidad del farmacéutico”, dispensar el envase serializado pero que no se podrá desactivar. “Si el farmacéutico comprueba que el sistema antimanipulación está intacto y que el fármaco lo ha adquirido por el canal habitual, entre otras cautelas, podrá dispensarlo a pesar de la alerta que genere el sistema”, indican. Dicha alerta será temporal, dado que el código del envase acabará cargándose a posteriori quedando cerrada la incidencia.
En España se darán instrucciones a las farmacias para que, cuando esto se produzca, se permita, “bajo responsabilidad del farmacéutico”, dispensar el envase serializado pero que no se podrá desactivar
Desde la industria reconocen que esto es así, pero que los titulares de autorización de comercialización (TAC) están comprometidos a cargar toda la información para la fecha límite, “otra cosa es que EMVO aguante la carga masiva de datos” y se produzca un cuello de botella en estos días que impida que los códigos de lo que se ha comercializado con envase serializado esté en los repositorios nacionales y europeo.
En España
La información que manejan los agentes y EMVO, además, es que se trata de un número importante de envases. Los datos de España, a finales de la semana pasada, indicaban que de los 350 TAC autorizados, había 183 conectados y sólo 71 cargando códigos.
La semana pasada, de los 350 TAC, sólo había 183 conectados y 71, cargando códigos

Por otro lado, también confirman desde Sevem que el día 9 de febrero habrá en el mercado envases con código Data Matrix que no son acordes al reglamento europeo sino que se han fabricado para otros países y que tampoco estarán en el sistema, lo que generará “falsos positivos”. En este caso la solución ha sido otra: desde el Consejo General de COF se ha introducido en Nodofarma Verificación un algoritmo que evitará estas alertas para que el fármaco no quede inmovilizado.
Estas casuísticas han sido redactadas en un “documento de procedimiento” dentro del Sevem y con el acuerdo de la Agencia Española de Medicamentos que tiene que ser ratificado por la autoridad nacional, para comunicarse después a los COF y éstos, a su vez, a las farmacias. En este documento también se incluirían otras cuestiones clave, como, por ejemplo, la verificación en los centros sociosanitarios.



